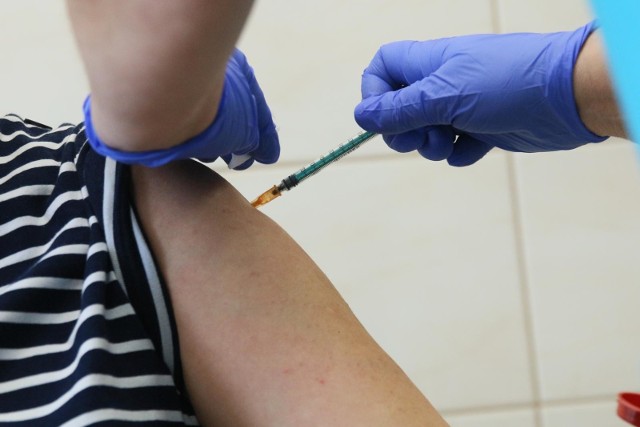
Europejska Agencja Leków (EMA) otrzymała we wtorek, 16 lutego 2021 r. wniosek o warunkowe pozwolenie na dopuszczenie do obrotu szczepionki Janssen przeciwko COVID-19. EMA przeprowadzi teraz dokładną ocenę naukową w przyspieszonym harmonogramie, na podstawie której wydane zostanie pozwolenie na dopuszczenie do obrotu na terenie UE.
Notowana na giełdzie w Nowym Jorku firma Johnson & Johnson (NYSE: JNJ) przygotowała jednodawkową szczepionkę przeciwko COVID-19. Po przyznaniu warunkowego pozwolenia na dopuszczenie do obrotu firma musi spełnić określone zobowiązania w określonych ramach czasowych, w tym dostarczyć dodatkowe dane.
Szczepionka firmy Janssen wykorzystuje własną platformę technologiczną AdVac®. Tę samą technologię wykorzystano m.in. do opracowania i produkcji niedawno zatwierdzonej przez Komisję Europejską szczepionki Janssen przeciwko wirusowi Ebola.
Badania kliniczne z udziałem osób dorosłych w wieku powyżej 18 roku życia zostało zaprojektowane w celu oceny bezpieczeństwa i skuteczności badanej szczepionki firmy Janssen w zakresie ochrony przed umiarkowanym i ciężkim przebiegiem choroby COVID-19. Badanie przeprowadzone w ośmiu krajach na trzech kontynentach, jak zapewnia firma, obejmuje zróżnicowaną i szeroką populację.
W całej Europie wciąż istnieje pilna potrzeba wprowadzania na rynek dodatkowych szczepionek przeciwko COVID-19, a nasz wniosek jest znaczącym krokiem w zapewnieniu Unii Europejskiej kolejnej opcji, która pomoże zmniejszyć negatywne skutki pandemii w Europie i na całym świecie - mówi dr Paul Stoffels, wiceprzewodniczący komitetu wykonawczego i dyrektor ds. naukowych, Johnson & Johnson.
Szczepionka Janssen może być dystrybuowana standardowymi kanałami dystrybucji szczepionek. Jeśli produkt zostanie dopuszczony do obrotu w UE, szacuje się, że utrzyma ona swoje właściwości przez dwa lata przechowywana w temperaturze -20°C, z czego przez co najmniej trzy miesiące może być przechowywana w temperaturze 2-8°C.
Wybory 2025. Zwycięstwo Nawrockiego, wysoka frekwencja
Wnioski dotyczące badanej jednodawkowej szczepionki przeciwko COVID-19 złożono w różnych krajach na całym świecie oraz w Światowej Organizacji Zdrowia (WHO). Spółka złożyła wniosek o zezwolenie na stosowanie produktu w Stanach Zjednoczonych 4 lutego 2021 r.
Europejska Agencja Leków (EMA) sprawdza w tej chwili szczepionki firm CureVac i Novavax. Obecnie na rynek Unii Europejskiej dopuszczone są trzy preparaty - BioNTech/Pfizer, Moderna i AstraZeneca.
Szczepionki dla Unii Europejskiej - lista firm
- BIONTECH-PFIZER - do 600 mln dawek
- CUREVAC - do 405 mln dawek
- JOHNSON & JOHNSON - do 400 mln dawek
- ASTRA ZENECA - do 400 mln dawek
- SANOFI-GSK - do 300 do mln dawek
- MODERNA - do 160 mln dawek
- NOVAVAX - do - 100 + 100 mln dawek
- VALNEVA - do - 30 + 30 mln dawek


![Jak się zapisać na szczepienie przeciw COVID-19 krok po kroku [PORADNIK]](https://d-art.ppstatic.pl/kadry/k/r/1/56/15/5ffc7b2fec0d0_o_xsmall.jpg)









![Niderlandy atakują. Rywale remisują. Nasi się czają. Nawet ci z ekstraklasy [WIDEO]](https://d-pa.ppstatic.pl/frames/pa-def/3e/a2/il20250608_916044465_mini.jpg)




